
黔南专业补齐产业发展短板此标准适用于参与医疗器械生命周期中某个或多个阶段的机构,当中包括设计、开发、生产、储存、分发、安装和维修,以及设计、开发和提供相关活动(如技术支援)。相较于旧版本,新版本加强了质量管理体系与法规要求的互动、标准在产品整个生命周期中的适用范围(如包括该医疗器械的分销商及进口商),于质量管理体系中更广泛地纳入风险管理的原则。除非有特别指明,否则ISO 13485:2补齐产业发展短板申报公司016标准的要求适用于任何规模及类型的机构。此外,标准中所有适用于医疗器械的要求,亦同时适用于机构提供的相关服务。

黔南专业补齐产业发展短板合同签订:在正式审核前,认证机构还需要与公司签订认证合同。这才是重要的,毕竟人家认证机构也不是公益单位。至于合同内容,你根本不需要了解,只需要知道合同金额,我当初所在的机构,一般收人家一万多,具体金额因公司规模、审核内容、机构而异。认证审核:合同签订完,认证机构就开始干活了,针对初补齐产业发展短板申报公司次认证,认证机构一般分预审、正式审核两次进行体系审核工作。一次预审,主要是因为认证机构初到单位,还不是很熟恐公司的情况,所以对公司有个初步的了解。

黔南专业补齐产业发展短板“医疗器械”是指任何用作诊断、预防及治疗疾病的产品,小至伤口敷料、心脏起搏器,大至牙科椅、维持生命仪器以及体外诊断试剂等。大学、技术学校、研究机构、技能鉴定等提供的有关培训和能力培养方面的资料和要求;客户反馈和投诉;外部的满意度调查报告;收集的与产品和服务有关的地区、民俗、地质、气候、经补齐产业发展短板申报公司济、人文方面的正式报告;来自竞争对手的重要报告、报道、通讯、文献、技术资料等;)与组织质量管理有关的新闻报道。
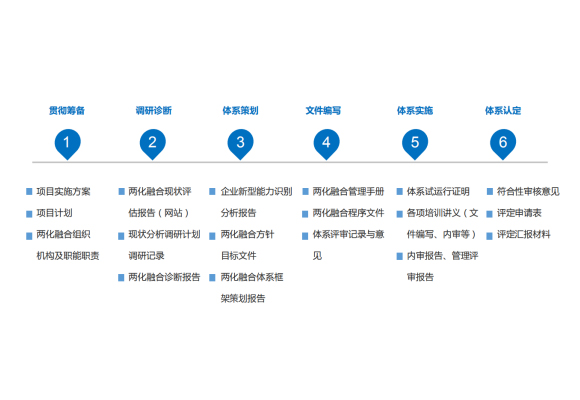
黔南专业补齐产业发展短板由于ISO13485标准早在2010年之前已开展修订程序,比ISO指引中“附件SL”的出版还要早,因此ISO13485标准并非采用“附件SL”内的“高阶架构”及“相同文本”,其条纹架构较贴近ISO 9001标准的2008年旧版本。不过,ISO13485标准在词汇的定义上引用了ISO 9001:2015标准(虽然当中ISO 9000部分词汇的定义已适应ISO13485标准的规定内涵而作出修改),而ISO 13485:2016标准的“附件B”也提补齐产业发展短板申报公司供了与ISO9001:2015标准内容的比较。基于ISO13485标准针对的是需高度规定约束的行业,因此,明文规定的要求会比ISO9001:2015标准更多,包括需编写的质量手册及其他文件化程序。
黔南专业补齐产业发展短板现场审核分为两个阶段,一阶段审核称为文件审核,审核通过后的3个月内,进行二阶段的正式审核,组织在3个月内对不符合项进行整改关闭,认证中心对整改完成情况进行验证,这种验证可能是书面的,也可能要到现场进行验证,验证完成后如果符合要求,则表示组织通过了ISO/TS16949:2002认证,自此算起,一般不超过3个月就可拿到认证证书。注意,这只是通常情况,不同认证中心的承诺,可能是补齐产业发展短板申报公司不一样的。从二阶段现场审核后算起,6个月进行一次监督审核,以后每12个月进行一次监督审核,有2次。